1年生の微生物学実習で初代培養を行いました。
細胞を一週間培養し、マウスアデノウイルスを感染させました。
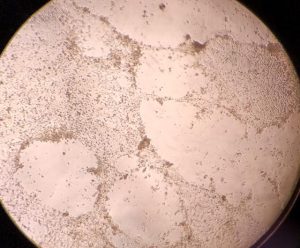
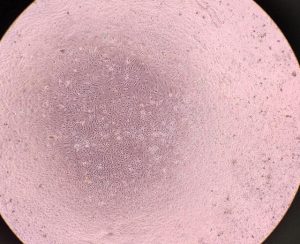
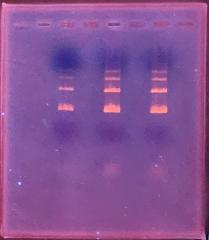
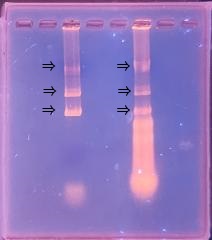
さらに1週間培養し、細胞変性効果(CPE)を倒立顕微鏡で観察しました。
感染前は全面にのびていた細胞が。。。
円形化したり、膨化したり細胞が変性しています。
ウイルス濃度が高いウエルでは細胞間に隙間が空き、変性して丸くなっていました。
ウイルスは小さいので直接観察することはできません。
細胞に感染させることで、その存在を知ることができます。
今年度は細胞がとてもよい状態で培養できましたので、
細胞変性効果がわかりやすく、観察できました。