みなさん、こんにちは。
今回の生化学実習では、前回分離した卵白アルブミンの定量を行いました。
最初に、透析処理をした外液に塩化バリウムを入れてみました。
硫酸イオンとバリウムイオンで、硫酸バリウムの白色沈殿ができます。

左から外液の交換1回目、2回目、3回目、4回目です。
4回目の右側のビーカーには、沈殿がほとんどありません。透析(脱塩)もしっかりできたようです。
それでは、早速、卵白アルブミンの定量です。
最初に、分離した卵白アルブミンの吸収曲線の作成を行いました。

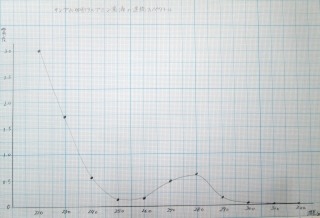
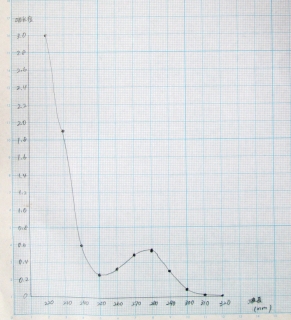
最大吸収波長は、タンパク質の280nmにありました。

いよいよ定量です。今回は、ビウレット反応を行いました。
ビウレット試薬は青色ですが、タンパク質と反応すると赤紫色に呈色します。
こちらは、卵白アルブミン標準液の反応です。


続いて、分離した卵白アルブミン溶液の反応です。しっかり反応しています。

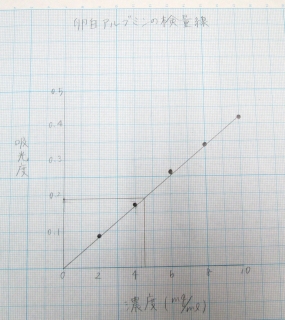
検量線を作成して、分離した卵白アルブミンの定量を行いました。
2年生のみなさん、タンパク質の性質を利用した実習でしたが、しっかり理解できましたか。
まだまだ生化学実習は、続きますので、しっかり頑張っていきましょう。
↓↓クリックお願いします