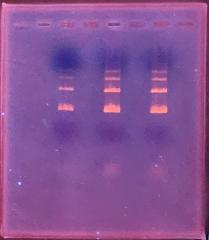
1年生の遺伝子操作学実習では最後に実技試験があります。
午前チームは3時間以内に全員終了しました。
午後チームはどうなるでしょうか。
解答用紙へ実際に行った操作を記録していきます。
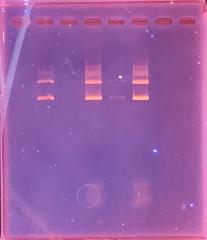
作業の途中に電気泳動用bufferを希釈します。
メスアップの時はメニスカスをしっかりと合わせましょう。
アガロースゲルは電子レンジで溶解します。
作業は慎重に。。。
午後チームも大幅に時間を過ぎることもなくできました。
実技試験では、1年間に学んだことがどれくらい身に付いているのかを、お互いに確認するために行っています。
2年生に向けて、出来なかったところなどは復習しておくといいと思います。