みなさん、こんにちは。
バイオコース2年生の生化学実習の実技試験の様子をご紹介します。
毎年、学生は、悩みに悩んで取り組んでいる実技試験です。
今年はどうでしょうか。
では早速、最初のグループからご覧ください。
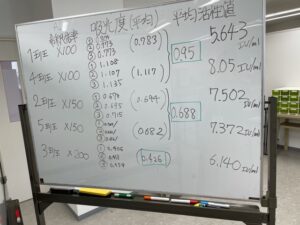
最初に各自で実習計画を考えから実技試験が始まります。
スタートは好調のようです。
少し余裕があるようです。
実技試験途中から第2グループが始まります。少し緊張気味のようです。
第1グループは、各自それぞれ計画に沿って取り組んでいるようです。
第1グループは、まとめの時間に入りました。
第2グループも各自実技試験が始まりました。
奥の学生が何か頭を抱えているような・・・。
ガンバレ!!!
第1グループが終了し、入れ替わりで第3グループが始まります。
まずは、最初に実習計画から考えます。
第3グループも実技試験が始まりました。
2年生のみなさん、実技試験はいかがでしたか。
今年は、少し余裕があったかな?
ほぼ全員が、実習計画をたて、実技試験を行えたと思います。
卒業までしっかり技術を磨いていきましょう。
おつかれさまでした。