2年生の遺伝子工学実習で、
コロニーハイブリダイゼーションを行いました。
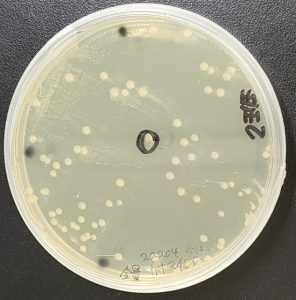
形質転換した菌が生えているシャーレに
メンブレンフィルターを密着させて、
コロニーの細菌をメンブレンに写し取ります。
写し取った細菌を処理して、
1本鎖にしたDNA分子を
メンブレンフィルターへ固定します。
以前行った、
サザンブロッティングのメンブレンフィルターと共に、
ハイブリダイゼーションを行います。
ハイブリダイゼーションでは、
塩基配列の相補性を利用して、
特定の塩基配列や遺伝子が検出できます。
コロニーハイブリダイゼーションでは、
メンブレン上に写し取ったコロニー内に、
目的の遺伝子が存在するかどうかがわかります。
サザンブロッティングしたメンブレンでは、
目的の遺伝子の存在と、
そのDNA断片の大きさもわかります。
検出するには、
標的となる特定の配列のすべて、
または、
一部に対して相補的な一本鎖DNA(RNA)をもとに
作製された標識プローブを用います。
メンブレンフィルターに固定された一本鎖DNAと
標識プローブの塩基配列が同じ、または似ていれば、
相補的に二本鎖を形成します。
今回の標識プローブは、
酵素が標識してあるので、
基質と反応させて発色を得ます。
発色しているところには、
目的の遺伝子が存在していることになります。
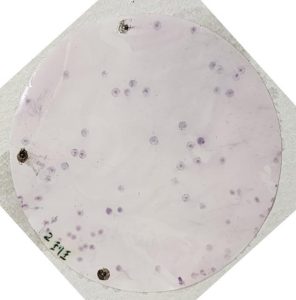
コロニーハイブリダイゼーション↓
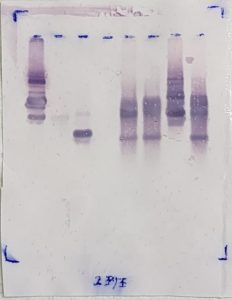
サザンハイブリダイゼーション↓
コロニーハイブリダイゼーションで
発色している場所のコロニーを培養すると、
目的の遺伝子を持つ細菌が得られます。
サザンハイブリダイゼーションで
発色しているDNA断片は目的の遺伝子と、
同じ塩基配列を持つことがわかります。
操作が多く、
時間がかかり、
発色するまで結果がわからないので、
今何が起こっているのかを
考えながら取り組むことが大切ですね。